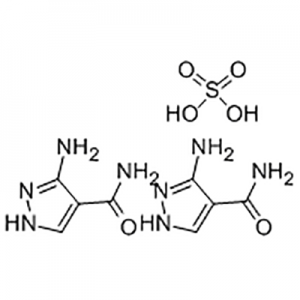
Asam 2′-Metoksi-3′-nitro-bifenil-3-karboksilat
Asam 2′-Metoksi-3′-nitro-bifenil-3-karboksilat
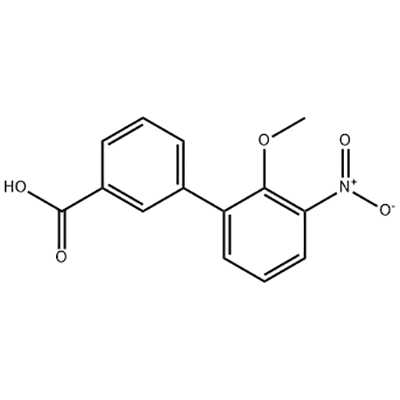
Asam 2'-Methoxy-3'-nitro-biphenyl-3-carboxylic digunakan sebagai perantara Eltrombopag.
Eltrombopag, dikembangkan oleh GlaxoSmithKline (GSK) di Inggris dan kemudian dikembangkan bersama dengan Novartis di Swiss, adalah agonis reseptor TPO non peptida molekul kecil pertama dan satu-satunya yang disetujui di dunia.Eltrombopag disetujui oleh FDA AS pada tahun 2008 untuk pengobatan purpura trombositopenik idiopatik (ITP), dan pada tahun 2014 untuk pengobatan anemia aplastik berat (AA).Itu juga merupakan obat pertama yang disetujui oleh FDA AS untuk pengobatan AA dalam 30 tahun terakhir.
Pada bulan desember 2012, FDA AS menyetujui Eltrombopag untuk pengobatan trombositopenia pada pasien dengan hepatitis C kronis (CHC), sehingga pasien hepatitis C dengan prognosis buruk karena jumlah trombosit yang rendah dapat memulai dan mempertahankan terapi standar berbasis interferon untuk penyakit hati.Pada tanggal 3 Februari 2014, GlaxoSmithKline mengumumkan bahwa FDA memberikan kualifikasi obat pengobatan terobosan Eltrombopag untuk pengobatan hemopenia pada pasien dengan anemia aplastik buku kimia (SAA) yang parah yang tidak sepenuhnya menanggapi imunoterapi.Pada tanggal 24 Agustus 2015, FDA AS menyetujui Eltrombopag untuk pengobatan trombositopenia pada orang dewasa dan anak-anak berusia 1 tahun ke atas dengan trombositopenia imun kronis (ITP) yang memiliki respons yang tidak memadai terhadap kortikosteroid, imunoglobulin, atau splenektomi.Pada 4 januari 2018, Eltrombopag disetujui untuk terdaftar di China untuk pengobatan trombositopenia imun primer (ITP).



![pentametilena bis[1-(3,4-dimetoksibenzil)-3,4-dihidro-6,7-dimetoksi-1H-isokinolin-2-propionat], dioksalat](http://cdn.globalso.com/jindunchem-med/image281-300x300.png)

![Casp ungin Asetat;Caspofungin asetat;Cancidas;Caspofungin asetat [USAN:BAN:JAN];](http://cdn.globalso.com/jindunchem-med/fbe17385-300x300.jpg)